日本兽医器械监管对我国的启示
|
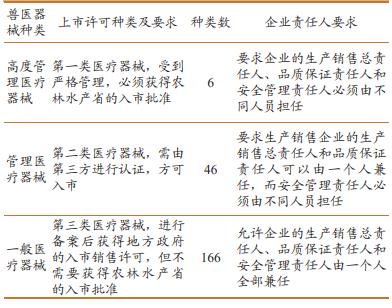
农林水产省负责兽医器械监管的下属机构及其主要职责: (1)消费安全局畜牧渔业安全管理司:负责兽医器械的风险管理、操作规范、生产和销售许可、制造和维修许可、国外兽医器械的认证和药事监督。 (2)兽医检验实验室:负责兽医器械的审批、复审和复评, 良好生产规范(good manufacturepractice,GMP) 合规性调查, 申请材料 [ 包括良好实验室操作规范(good laboratory practice,GLP)、 良好临床试验规范(good clinicalpractice,GCP)等 ] 可靠性调查,以及技术指导和质量检验。 (3)食品药品委员会兽医药品事务分会:负责重要事项的审议,如新型兽医器械的审批、复审等。 2.2 上市许可 日本按照对动物生命和健康影响的风险高低,将兽医器械分为 3 类(表 1)。第一类是高度管理医疗器械,指出现副作用或功能障碍时,有较大风险对动物生命和健康产生严重影响的产品,例如人工心脏瓣膜、人工心肺机、人工肾装置等,这类器械需要在上市前获得一类医疗器械制造和销售许可。第二类是管理医疗器械,指出现副作用或功能障碍时,有中等风险对动物的生命和健康产生严重影响的产品,例如麻醉机、呼吸器、植入体内的功能代用品等,这类器械需要在上市前获得二类医疗器械制造和销售许可。第三类是一般医疗器械,是严格控制类医疗器械和控制类医疗器械之外的产品,即使出现副作用或功能障碍,也几乎不影响动物的生命和健康,例如手术台、医用照明器具、医用消毒液等,这类器械需要在上市前获得三类医疗器械制造和销售许可。对于第三类医疗器械,需要向地方政府相关部门进行备案,经认定后即获得入市许可,无需获得农林水产省的入市批准,农林水产省对其入市也不作管理规定;对于第二类医疗器械,须由第三方机构进行认证,农林水产省会对第三方机构进行定期审核;第一类医疗器械则受到严格管理,必须获得农林水产省的入市批准。 表 1 日本兽医器械监管一览表 日本农林水产省消费安全局畜牧渔业安全管理司负责审查兽医器械的生产销售申请,审查时限一般为 6 个月(不包括生产企业补充资料、修复漏洞的时间),已获批的申请每 5 年复审 1 次,复审处理期一般为 3 个月。获得一类医疗器械制造和销售许可的厂家自动视为获得了二类、三类许可,获得二类许可的厂家自动视为获得了三类许可。 |
下一篇:荷兰动物育种规划及其对中国的启示