农业农村部:兽用生物制品生产企业全面开展非瘟病毒核酸检测的公告
|
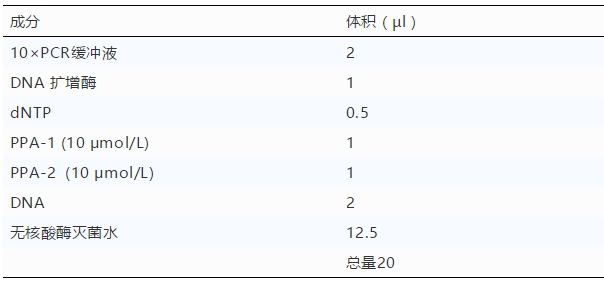
4.2.1.1.2扩增引物 primer PPA-1(10 μmol/L):5'-AGTTATGGGAAACCCGACCC-3' (上游引物); primer PPA-2(10 μmol/L):5'- CCCTGAATCGGAGCATCCT-3' (下游引物)。 4.2.1.1.3 DNA分子量标准品 DL500。 4.2.1.1.4 TAE电泳缓冲液 配制方法见《电泳液标准配制流程》。 4.2.1.1.5 1%琼脂糖凝胶板 在100 ml 1×TAE缓冲液中加入1g琼脂糖,加热融化,加入5.0 μl (10 mg/ml)溴化乙锭,混匀,倒入水平放置的凝胶盘中,胶板厚度达5.0 mm左右。根据样品数量选用适宜的梳子。待凝胶冷却凝固后拔出梳子(胶中形成加样孔),放入电泳槽中,加1×TAE缓冲液淹没胶面。 4.2.1.2 仪器 DNA扩增仪,稳压稳流电泳仪,水平电泳槽,凝胶成相系统(或紫外透射仪),微量移液器1套。 4.2.1.3 耗材 1.5 ml带盖离心管、0.2ml薄壁PCR管、无菌吸头(0~10 µl、0~200 µl、100~1000 µl)。 4.2.2操作程序 4.2.2.1 样品DNA制备 按照前述方法进行核酸提取。 4.2.2.2 反应体系的配制 配制比样品数量至少多3个的反应体系,同时设立阳性和阴性对照。在阳性对照反应管中加入非洲猪瘟P72基因重组质粒2.0 µl,在阴性对照反应管中加入2.0µl无核酸酶灭菌水。每个PCR反应管中应包含以下成分: 4.2.2.3 反应程序 将所有待检样品及阳性和阴性对照反应管放在PCR仪中,按照以下程序进行扩增:94℃2分钟,94℃30秒,60℃30秒,72℃30秒,35个循环;72℃10分钟。4℃保存。 4.2.2.4 PCR扩增产物分析 取PCR扩增产物10 µl,加6×加样缓冲液2.0 µl,混匀,用1.5%琼脂糖凝胶对混合物进行电泳分析,电压120V,电流50 mA,电泳时间30分钟。电泳结束后,用凝胶成像系统拍照,记录检测结果。 4.2.2.5 结果判定 4.2.2.5.1 质控标准 对照组的检测结果应符合以下情况,此次检测方为有效: 阴性对照应不出现257bp的特异性条带。 阳性对照应出现257bp的特异性条带。 4.2.2.5.2 判定 阳性:待检样品出现与阳性对照大小一致的扩增条带,判定为非洲猪瘟病毒核酸阳性,扩增产物可通过DNA测序进一步确定基因型。 阴性:待检样品未出现与阳性对照大小一致的扩增条带,判定为非洲猪瘟病毒核酸阴性。 4.3 注意事项 4.3.1检测过程中应遵循PCR实验分区原则,即应区分试剂配制区、样本处理区、核酸扩增区。 4.3.2应避免在含有靶序列的区域中使用引物,防止污染靶序列。 |
上一篇:农业农村部、市场监管总局:做好非洲猪瘟病毒检测结果通报和发布..
下一篇:中国农科院:非洲猪瘟防控科研计划(2018-2022年)