农业农村部:兽用生物制品生产企业全面开展非瘟病毒核酸检测的公告
|
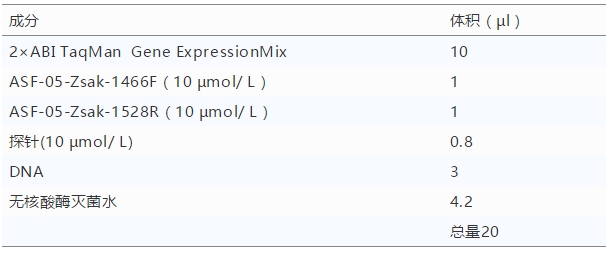
4.1.1.1.2 扩增引物及探针扩增引物: ASF-05-Zsak-1466F(10µmol/L):5'-CCTCGGCGAGCGCTTTATCAC-3' ASF-05-Zsak-1528R(10µmol/L):5'-GGAAACTCATTCACCAAATCCTT-3' 探针ASF-05-Zsak-1486prob(10µmol/L):5'-FAM-CGATGCAAGCTTTAT-MGB-3' 4.1.1.1.3 无核酸酶的灭菌水 PCR级别。 4.1.1.2 仪器 荧光定量PCR仪;微量移液器1套(最大量程分别为10µl、100 µl、200 µl、1000 µl)。 4.1.1.3 耗材 1.5ml带盖离心管、0.2 ml薄壁PCR管、荧光定量PCR 96孔板、0.1 ml荧光PCR八连管、无菌吸头(0~10 µl、0~200 µl、100~1000 µl)、一次性乳胶手套。 4.1.2 操作程序 4.1.2.1 样品DNA制备 按照前述方法进行核酸提取。 4.1.2.2 反应体系的配制 配制比样品数量至少多4个的反应体系,同时设置强阳性、弱阳性和阴性对照。在强阳性和弱阳性对照反应管中分别加入含有非洲猪瘟P72基因的标准质粒DNA各3 µl,在阴性对照反应管中加入3µl无核酸酶灭菌水。每个PCR反应管中应包含以下成分: 4.1.2.3 反应程序 将所有待检样品和强阳性、弱阳性、阴性对照反应管放在荧光定量PCR仪中,按照以下程序进行扩增:50℃2分钟,95℃5分钟,95℃15秒,58℃退火延伸1分钟,45个循环(荧光信号收集在此阶段每次循环的退火延伸时进行)。 4.1.2.4 结果判定 4.1.2.4.1 阈值设定 试验操作结束后,确定Ct值。Ct值为每个样品反应管内荧光信号到达设定阈值时所经历的循环数。 阈值设定原则:根据仪器噪声情况进行调整,以阈值线刚好超过阴性对照扩增曲线的最高点为准。 4.1.2.4.2 质控标准 对照组的检测结果应符合以下情况,此次检测方为有效: 阴性对照无Ct 值,且无扩增曲线。 强阳性对照的Ct 值应在18~22之间,并出现典型的扩增曲线。弱阳性对照的Ct 值应在33~35之间,并出现典型的扩增曲线。 4.1.2.4.3 判定 阴性:无Ct值,且未出现扩增曲线,判定为样品中无ASFV核酸。 阳性:Ct值≤40,且出现典型的扩增曲线,判定为样品中存在ASFV核酸。 可疑:Ct值>40,且出现典型扩增曲线,判定为可疑,应重检。重检后,Ct值≤40且出现典型扩增曲线者判为阳性,其他情况均判定为阴性。 4.2 普通 PCR检测法 4.2.1 试剂和器材 4.2.1.1 试剂 4.2.1.1.1 PCR试剂 10×PCR缓冲液(含25 mmol/l Mg2+),DNA扩增酶,dNTP预混液。 |
上一篇:农业农村部、市场监管总局:做好非洲猪瘟病毒检测结果通报和发布..
下一篇:中国农科院:非洲猪瘟防控科研计划(2018-2022年)