猪塞尼卡谷病毒病现状与未来防控思考(图)
|
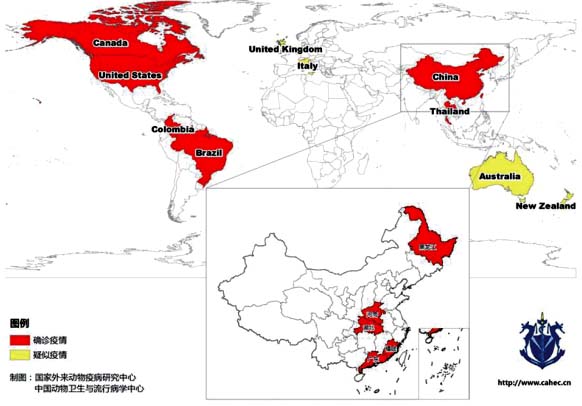
2002 年,美国基因治疗公司偶然从 PER.C6 细胞(转化的胎儿成视网膜细胞)培养基中首次发现并分离到一种新的病毒——塞尼卡谷病毒(SenecaValley virus,SVV,另称 Seneca virus A,SVA)。2015 年,国际病毒分类委员会(ICTV)将该病毒划分至新的病毒属——塞尼卡病毒属。目前,SVV 是该属唯一成员。SVV 结构呈二十面体,直径 30 nm,无囊膜。基因组为线性、不分节段、单股正链RNA,全长约 7.2~7.3 kb,5´ 和 3´ 有非编码区,具有多聚腺苷酸尾。病毒基因含 1 个开放阅读框(ORF),编码含 2 181 个氨基酸的多聚蛋白前体,之后被裂解为 1 个前导蛋白和 3 个主要多聚蛋白(P1、P2 和 P3)。P1 基因区域主要编码 4 个结构蛋白(VP4、VP2、VP3 和 VP1),形成病毒的核衣壳,而P2和P3基因区域编码7个非结构蛋白(2A、2B、2C、3A、3B、3C 和 3D)。SVV 与同科的心肌炎病毒属成员同源性最接近。2014 年以前,该病毒受关注度较低,仅有 SVV-001 等 3 个毒株全基因组序列被测定公布。同时研究发现 SVV-001有溶瘤特性,可专嗜性感染神经内分泌肿瘤细胞,而不感染正常人类细胞,并由此研发出了人用抗肿瘤药物 NTX-010。目前该药物尚处于临床试验研究阶段。 1 猪塞尼卡谷病毒病的发现与流行现状 早在 20 世纪 80 年代,澳大利亚、新西兰及美国就曾报道猪的一种水疱性疾病。其特征是患病猪鼻、口腔和蹄冠周围出现小泡和溃疡,但口蹄疫病毒(FMDV)、猪水泡病病毒(SVDV)等检测结果为阴性,未能对病原做出确诊。当时人们推测该病与猪饲料原料(感染真菌核盘菌的防风草、芹菜叶或海产品)和光照有关。2004 年,美国印第安纳州猪群暴发水疱性疾病,但未能确诊病因。根据临床症状将其命名为猪原发性水疱病(PIVD)。英国(2007 年)和意大利(2010 年)也曾暴发过类似的水疱性疾病,但也未能确诊病原。 2007 年,美国从加拿大进口的 187 头猪出现水疱病症状,发病率高达 80%。在排除了 FMDV和 SVDV 等病毒后, 最终确诊为 SVV 感染;2012 年,美国又在出现水疱症状的 6 月龄猪体内检测到 SVV,进而推测 SVV 感染与水疱性疾病有关。2015 年,美国中西部多个地区暴发猪水疱性疾病,新生仔猪死亡率达 30%~70%。由于病原不明,该水疱病的出现一度给美国养猪业造成了很大恐慌。对于该病,美国在鉴别诊断、主动监测和病毒致病机制研究等方面投入很高,影响了整个行业的正常发展;通过 RT-PCR 方法对患水疱病猪进行检测,证实该病与 SVV 感染有关。 2014 年伊始,全球多个国家确诊了猪 SVV 疫情。除美国外,2014 年底至 2015 年初,巴西的 6个州成年猪及断奶仔猪出现水疱性症状,1~4 日龄新生仔猪死亡率上升。经实验室检测,在粪便、血清和多个器官组织中检测出 SVV 阳性。2015年3月和 7月,我国广东省发现了 SVV 感染导致的猪水泡性疾病。2016年,加拿大、哥伦比亚和泰国发现了猪 SVV 感染。2016—2017 年,我国又从湖北、福建、河南和黑龙江等省的患病猪群中陆续分离到 SVV(图 1)。 图1 SVV 确诊和疑似疫情分布(截至 2017年12月) 2 临床表现 猪感染后通常表现为急性、自限性水疱症状。临床表现为采食量下降,之后鼻吻出现水疱性病变,可见 1 个或多个大小不一、充满液体的囊泡;囊泡破裂后发展成溃疡病变,在感染后 10~15 d 形成厚痂。水疱性及溃疡性病变多出现于蹄冠部趾间裂和冠状带周围,导致边缘上皮疏松坏死,严重者跛行,站立困难(图 2)。有些母猪腹部和乳房部出现红色斑点,或伴有发热和厌食症状,甚至发烧(39.5~40.5 ℃),部分跛行的母猪体温可达 41.0 ℃。新生仔猪体态虚弱,嗜睡,不愿吸乳,并出现急性死亡,在蹄掌部可见部分化脓性小泡。 |
上一篇:一例犬卵巢肿瘤的诊疗(图)