科学家发现非瘟病毒DNA连接酶关键位点残基
|
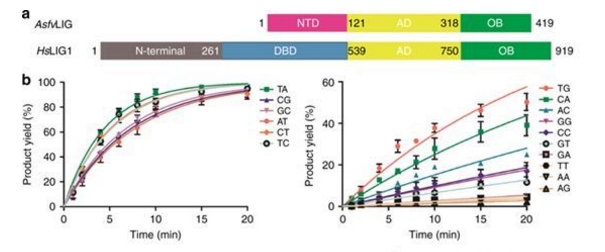
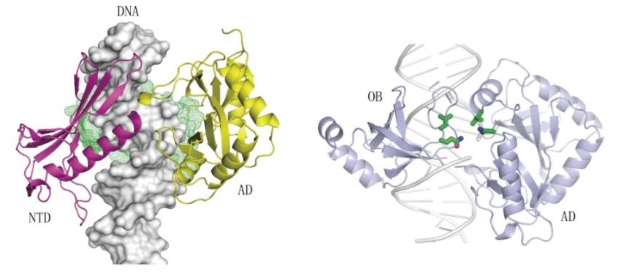
2019年1月23日,国际知名学术期刊《自然·通讯》(Nature Communications)在线发表了复旦大学及四川大学关于非洲猪瘟病毒(African swine fever virus,ASFV)来源的DNA连接酶(AsfvDNAL)的研究成果。 该文章发现的4种独特的结构特征可以作为小分子设计的潜在靶点,这可能会损害ASFV的基因组修复,并有助于今后对抗这种病毒。 1月23日,国际知名学术期刊《自然·通讯》(Nature Communications)在线发表了我院遗传工程国家重点实验室甘建华课题组与李继喜课题组合作的关于非洲猪瘟病毒(African swine fever virus,ASFV)来源的DNA连接酶(AsfvDNAL)的研究成果。该研究用X-射线晶体学方法解析了AsfvDNAL与不同类型DNA复合物的结构,揭示了AsfvDNAL结合和催化底物连接的分子机制,为针对非洲猪瘟病毒DNA修复通路蛋白的药物设计提供了结构基础。 图1 AsfvDNAL与DNA底物复合物的晶体结构 ASFV病毒是一种独特的双链DNA病毒,既能感染野生猪,也能感染家猪。一旦爆发,将会导致近100%受感染猪的死亡。自1921年被发现以来,ASFV病毒受到了科研人员的广泛关注,但目前仍没有任何有效的疫苗被报道。ASFV病毒对全球多个国家和地区的猪饲养业都是一种巨大的威胁,并于2018年在中国首度爆发,导致了严重的经济损失。ASFV病毒编码了多个蛋白,形成了一套完整的DNA修复通路。与通常的DNA修复通路不同,ASFV DNA修复通路中的DNA聚合酶(AsfvPolX)和连接酶AsfvDNAL的保真性都非常低,在ASFV病毒基因组的修复和突变过程中均发挥了关键作用。本团队早期研究发现,AsfvPolX拥有一个独特的磷酸根识别位点,对其底物结合和催化活性十分关键(Plos Biology,2017)。 AsfvDNAL与同源蛋白的序列相似性很低,其容忍碱基错配的分子机制还不明确。针对上述问题,甘建华、李继喜和黄震团队利用晶体学手段,成功解析了AsfvDNAL与不同DNA底物的高分辨率结构(图1)。晶体结构显示,AsfvDNAL的N-端具有一个独特的DNA结合结构域(NTD),该结构域对底物结合十分重要。虽然AsfvDNAL与常见的DNA连接酶在催化机制方面保守,AsfvDNAL在底物催化位点附近具有一些明显不同的氨基酸组成。蛋白突变、体外DNA结合以及活性研究显示,催化位点附近的氨基酸对催化形式AsfvDNAL-DNA复合物的形成及活性至关重要。 博士生陈屹勍为论文的第一作者,复旦大学的甘建华教授、李继喜教授以及四川大学的黄震教授为并列通讯作者。该研究得到了复旦大学生科院麻锦彪教授课题组的大力支持,并获得了国家自然科学基金和科技部国家重点研发计划的资助。 |
下一篇:四川省绵阳市盐亭县和黑龙江省鸡西市鸡冠区非洲猪瘟疫区解除封锁..